خريطة مفاهيم الروابط الكيميائية

تعد “خريطة مفاهيم الروابط الكيميائية” واحدة من أهم الخرائط التي يبحث عنها العديد من الطلاب والمعلمين، حيث تساعد في فهم الروابط الكيميائية وأنواعها بشكل أسهل. فالروابط الكيميائية من الدروس التي يجب دراستها في مختلف المراحل الدراسية، حيث تساهم في فهم علم الكيمياء والفيزياء، حيث يرتبط كل منهما بالآخر في العديد من الأشياء التي يبدأ ظهورها لكل من يدرسهما.
لهذا السبب، نقدم لك في هذا المقال على موقع الموسوعة خريطة مفاهيم الروابط الكيميائية، بالإضافة إلى تعريف هذه الروابط وذكر أنواعها وخصائصها، بالإضافة إلى توضيح عدد من التفاصيل والمعلومات المتعلقة بها بشكل عام.
خريطة مفاهيم الروابط الكيميائية
تُعَدُّ الروابط الكيميائية من أهم الخصائص التي تميِّز كلًا من علم الكيمياء وعلم الفيزياء، وعلى الرغم من وجود تلك الروابط بكثرة في الكيمياء، إلا أن بعض المعلومات التي تتعلق بالفيزياء تنطوي عليها أيضًا، ولذا فإن مخطط المفاهيم الكيميائية يُعَدُّ واحدًا من الخرائط التي توضح تلك الروابط بطريقة بسيطة.
- تتميز الروابط الكيميائية بأنواع مختلفة، حيث يختلف كل نوع عن الآخر بسبب حالة الذرات والجزيئات، كما يختلف أيضًا بناءً على احتياجات الذرات والجزيئات لتحقيق الاستقرار.
- وإليكم خريطة مفاهيم الروابط الكيميائية متمثلة في الأتي:
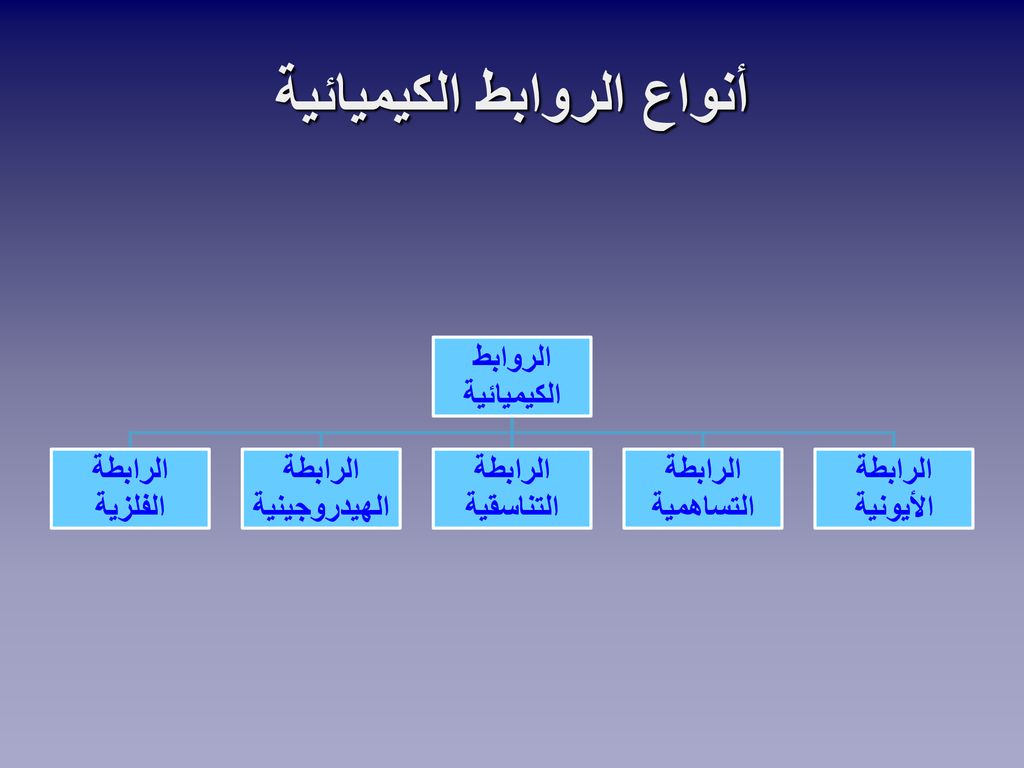
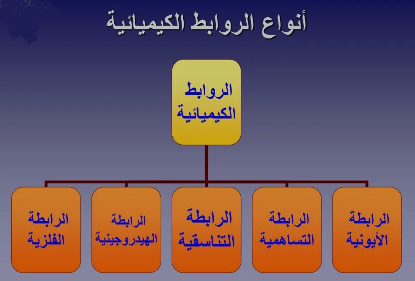
الروابط الكيميائية
الروابط الكيميائية هي الروابط التي تربط الذرات مع بعضها البعض، وهي أساس علم الكيمياء، وليس مفهومها مقتصراً على الذرات فحسب، بل تشمل الجزيئات والتفاعلات الكيميائية.
- تعتبر الروابط الكيميائية ضرورية لتحقيق الجاذبية والتجاذب بين الذرات، وبدونها لن يكون هناك أي نتائج بعد أي تفاعلات كيميائية.
- لا تكون جميع الذرات مستقرة، ولذلك تبحث دائمًا عن الروابط الكيميائية التي تساعدها على تعبئة المدارات الخارجية الإلكترونية الخاصة بها لتصبح مستقرة، وهذا يشكل أحد أنواع الروابط الكيميائية.
كيف تتكون الروابط الكيميائية ؟
- تحدث الروابط الكيميائية حتى تصل كل ذرة إلى حالة الاستقرار الخاصة بها، وهذا ما تسعى إليه جميع الذرات المختلفة.
- تكون الروابط الكيميائية إما بالمساهمة والمشاركة أو بالفقد، وذلك يتم تحديده حسب نوع الرابطة الكيميائية.
خصائص الروابط الكيميائية
تتميز الروابط الكيميائية بعدد من الخصائص التي تجعلها فريدة من نوعها بالمقارنة مع الروابط الفيزيائية وغيرها، وتلك الخصائص تساهم في قوة الرابطة الكيميائية.
- ومن خصائص الروابط الكيميائية الأتي:
- الترتيب:
- يقصد بالترتيب هنا الترتيب الموجود ما بين الذرات داخل الجزيء، ذلك الترتيب يساعد في تحديد عدد الأزواج الموجودة بالمركبات، وكلما زادت عدد الذرات زادت قوة الجزيء والرابطة الكيميائية لتناسبهم تناسب طردي.
- الطاقة:
- تشمل هذه الطاقة القدرة المستنفدة التي يتم من خلالها فك الترابط بين الذرات الموجودة.
- القطبية:
- تتمثل القطبية في مقدار الجاذبية بين الذرات والسحابة الإلكترونية. وكلما زادت نسبة الجاذبية ، زادت نسبة القطبية تناسبًا طرديًا.
- الطول:
- يعني هنا بطول الرابطة الكيميائية هو المسافة بين نواتي الذرات، وتتناسب طول الرابطة عكسيًا مع قوة الرابطة، فكلما زادت المسافة، ضعفت قوة الرابطة الكيميائية.
- الترتيب:
الروابط الكيميائية وانواعها
توجد العديد من الأنواع المختلفة للرابطات الكيميائية، والتي تختلف عن بعضها البعض حسب حالة الذرات والجزيئات الموجودة في المواد، وليست الرابطة الكيميائية مقتصرة على نوع واحد فقط بل توجد منها أنواع عديدة.
- ومن أنواع الروابط الكيميائية التالي:
- روابط أيونية.
- روابط تساهمية.
- روابط تناسقية.
- روابط هيدروجينية.
- روابط فلزية أو معدنية.
- قوى فان دير فالس.
الروابط الأيونية
- الروابط الأيونية تحدث بين الذرات، وتتمثل في عملية نقل الإلكترونات بين الذرات، وفي هذه العملية، تكون الذرة إما تكتسب إلكترونًا أو تفقد إلكترونًا بناء على طبيعة الذرة.
- في هذه الحالة، يكون أحد الأيونيات يحمل شحنة سالبة ويسمى أنيون، ويحمل الأيون الآخر شحنة موجبة ويسمى كاتيون، ويتم جذب الأيونات ذات الشحنات المختلفة لبعضها البعض.
- عندما تتحد الذرات سويًا، تكوّن جزيء أيوني مكون من قسم موجب وقسم سالب.
- يتواجد في بعض المركبات ترابط أيوني مثل مركب كلوريد الصوديوم NaCl، حيث يتكون الصوديوم Na+ الموجب من خلال فقدانه إلكترونًا ونقله إلى الكلور Cl- السالب، ومن ثم يتم الاتحاد لتكوين جزيء كلوريد الصوديوم.
الروابط التساهمية
- الروابط التعاونية هي الروابط التي تتعاون مع بعضها البعض لتشكيل جزيء محدد، وهذا النوع من الروابط هو أكثر أنواع الروابط شيوعًا.
- وتنقسم الروابط التساهمية إلى:
- روابط تساهمية قطبية.
- روابط تساهمية غير قطبية (الروابط الهيدروجينية).
الروابط التناسقية
- الروابط التناسقية هي الروابط التي تكون في وسط ما بين الروابط التساهمية والروابط الأيونية، وذلك لأن أحد الجزئين في الجزيء يحمل شحنة سالبة والجزء الآخر يحمل شحنة موجبة.
- تسمى أيضًا الرابطة التساندية، وتهدف إلى تكوين الجزيئات.
الروابط الهيدروجينية
- الروابط الهيدروجينية هي الروابط التي تنشأ بين ذرة الهيدروجين H وزوج من الذرات الأخرى التي تتفاعل بشكل كبير مع الإلكترونات.
- تعد الرابطة الهيدروجينية أضعف من الرابطة الأيونية والرابطة التساهمية، وعلى الرغم من ذلك فهي أقوى من قوى فان دير فال.
- يمكن أن تكون الروابط الكيميائية بين جزيئات مختلفة أو بين ذرات من نفس الجزيء.
- ومن أشهر الروابط التي تُعد مثالاً على الرابطة الهيدروجينية:
- ارتباط ذرة أكسجين بذرة هيدروجين -OH.
- ارتباط ذرة فلور بذرة هيدروجين FH.
- ارتباط ذرة نيتروجين بذرة هيدروجين -NH-.
الروابط الفلزية أو المعدنية
- الروابط الفلزية أو الروابط المعدنية هي الروابط التي تربط بين الذرات في مواد المعادن، ويتميز هذا النوع من المواد بتواجد الذرات بشكل متين وثيق.
- في معظم الحالات، يحدث تداخل بين الغلاف الإلكتروني الخارجي لكل ذرة من الذرات المعدنية مع أعداد كبيرة من الذرات المجاورة لها، وبسبب ذلك، تقوم الإلكترونات التي تعرف باسم إلكترونات التكافؤ بالتحرك باستمرار للانتقال من ذرة إلى أخرى، ولا ترتبط بأي زوج معين من الذرات.
- تتحرك الإلكترونات التي توجد في تلك الروابط بحرية نسبية، حيث تمتلك حرية التحرك والانتقال بشكل غير ساكن تمامًا.
- تصبح الذرات التي تركتها الإلكترونات أيونات موجبة، وهذا يتسبب في حدوث تفاعل بين الإلكترونات الحرة والأيونات، ومن ثم يحدث قوة في التماسك والاحتمال.
قوى فان دير فالس
- تعتبر هذه القوة منخفضة مثل الرابطة الهيدروجينية، وتتشكل بين الذرات القطبية المرتبطة تساهمياً في تشكيل الجزيئات المختلفة.
- تزداد القوى الترابطية كلما اقتربت المسافة، ومن أمثلة ذلك ارتباط جزيئات البروتين.
تُعدّ علوم الكيمياء والفيزياء من أهم العلوم التي نتعامل معها بشكل يومي ومستمر، وهما علمان مترابطان في أغلب الأوقات ويكمّلان بعضهما البعض، وتشمل هذه العلوم الروابط الكيميائية التي تربط الذرات والجزيئات والمواد ببعضها البعض. لذلك، يبحث العديد من الأشخاص عن “خريطة مفاهيم الروابط الكيميائية” لفهم ماهيتها، ويقدم هذا المقال شرحًا وتوضيحًا للموضوع لتعم الفائدة على القارئ العزيز.
المراجع