سنتحدث في هذه المقالة من موسوعتنا عن مفهوم الجدول الدوري، ونتعرف على استخداماته المختلفة وأهميته، بالإضافة إلى دراسة خصائصه.
يتم دراسة الجدول الدوري في مادة العلوم في المراحل الأولى، وفي مادة الكيمياء في مراحل لاحقة، ويحتوي على العديد من العناصر، وسنتعرف عليه بشكل أفضل في الأسطر القادمة.
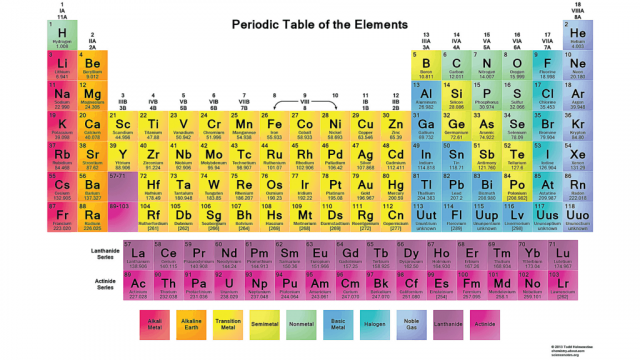
ماهو الجدول الدوري
إذا أردنا التعرف عليه، فسنجد أنه الجدول المنظم للعناصر الكيميائية، والذي تم اكتشافه وترتيب العناصر فيه حسب أعدادها الذرية وتوزيعها الإلكتروني الخاص بها، ولديها خواص كيميائية متكررة ويظهر صورة عامة على شكل اتجاهات دورية، حيث تكون العناصر المتشابهة في نفس الصف أو العمود الواحد، وتوجد الفلزات نحو الجهة اليسارية واللا فلزات نحو الجهة اليمنى. وتوضع العناصر التي لها سلوكيات كيميائية متشابهة في نفس العمود، وتسمى الصفوف بالدورات، والأعمدة بالمجموعات، ويحتوي على ست مجموعات بالإضافة إلى الأرقام المخصصة.
يعد الجدول الدوري واحدًا من أهم الأدوات المستخدمة في الكيمياء على المستوى الخاص، والتي تستخدم في العلوم بشكل عام.
تم اسماؤه بالجدول الدوري؛ نسبةً إلى تكرار العناصر الكيميائية المختلفة، ويتألف الجدول الدوري من 112 عنصرًا يتم تصنيفها إلى فئتي الفلزات واللافلزات، ويتم ترتيبها وفقًا لنسبة كتلة الذرة التي تشكل كل عنصر، كما يحمل كل عنصر عدد ذري يزيد بمقدار واحد عن العنصر الذي يسبقه في الترتيب.
هذا الجدول قابل للتغيير حيث يمكن للعلماء والباحثين اكتشاف عناصر جديدة أو الحصول على معلومات جديدة حول العناصر الموجودة في الجدول، وعند القيام بذلك، سيتم إدراج هذه المعلومات داخل الجدول.
إستخدامات الجدول الدوري
- يساعد الاشتقاق في تحليل العلاقات بين خصائص العناصر المختلفة، كما يساعد في الكشف عن الخصائص الكيميائية المحتملة للعناصر غير المكتشفة بعد، وكذلك في تحليل خصائص العناصر المركبة حديثًا.
- يتمتع الجدول الدوري بأهمية كبيرة لدى العلماء والطلاب الذين يدرسون الكيمياء، حيث يمكنهم من خلاله دراسة العناصر المختلفة ومعرفة خصائصها الفيزيائية والكيميائية، والتمييز بينها وبين بعضها البعض.
- يمكن معرفة مدى التفاعل بين عنصر وآخر.
- يمكننا اللجوء إليه في الأبحاث العلمية التي يتم إجراؤها في المدارس والجامعات، حيث يمكن للباحثين معرفة خصائص وميزات العنصر، سواء كانت كيميائية أو فيزيائية، ومن المعروف أنه حتى الآن يتم اكتشاف عناصر جديدة في جميع أنحاء العالم، ويتم إضافتها إلى العناصر الموجودة في الجدول الدوري.
خصائص الجدول الدوري
يتميز الجدول الدوري بالعديد من الخصائص والسمات الهامة ومن بينها:-
- تم العثور على 118 عنصرًا حتى الآن، وما زالت عمليات البحث والاستكشاف جارية للعثور على عناصر جديدة.
- تتألف غالبية العناصر في الجدول الدوري من المعادن، وتنقسم إلى معادن قلوية، أساسية، انتقالية أو معادن قلوية-ترابية.
- يتضمن الجدول الدوري 7دورات أفقية.
- يحتوي على 18 مجموعة وتكون على شكل أعمدة رأسية.
- يطلق على صفوف الجدول الدوري اسم `الدور`، ويتمثل رقم العنصر في هذا الدور بأقصى مستوى للطاقة للإلكترونات الغير مثارة.
- يتم الاعتماد في تصنيف العناصر على الزيادة في الأعداد الذرية الخاصة بالعناصر. ونجد أن حجم الذرة ينخفض عندما نتحرك من اليسار إلى اليمين خلال دورة واحدة، أما عندما نتحرك من الأعلى إلى الأسفل فنجد أن حجم الذرة يزيد في الدورة الواحدة.
- تتشابه عناصر المجموعة الواحدة في الجدول الدوري سواءً في الخصائص أو السمات، وتتشابه في ترتيب الإلكترونيات التي تتواجد في المدار الأخير.
- يتضمن الجدول العناصر المعدنية وغير المعدنية، ويتم تقسيمهما بوجود الشبه المعدنية.
- عند الانتقال من اليمين إلى اليسار في العناصر، ينخفض مستوى الكهروسلبية.
سمات أخرى للجدول الدوري
- عند الحديث عن العناصر في المجموعات الثالثة والثانية والأولى، يتبين أنهم يميلون لفقدان الإلكترونات لتصبح أكثر إيجابية كهربائيًا.
- ترغب عناصر المجموعة السادسة والخامسة والرابعة في اكتساب إلكترونيات لتصبح أكثر كهروسلبية.
- ينتهي كل دورة في الجدول الدوري بعنصر خامل، أي ذو نشاط كهربائي ضعيف، وهذا يعني أن المدار الأخير للإلكترونات فيه ممتلئ.
- توجد في أسفل الجدول الدوري سلسلتان طويلتان من العناصر، وتحتوي كل سلسلة على 14 عنصرًا وتنتمي إلى مجموعة العناصر الانتقالية، ويُطلق على السلسلة الأولى لانثانيدات والثانية أكتنيدات، وتم وضعها في هذا المكان لتوفير المساحة.
- يتميز كل عنصر برمز كيميائي يميزه عن العناصر الأخرى، ومثال على ذلك هو الأكسجين الذي يرمز له بالرمز O .
- في هذا الجدول، نجد أن الإلكترونات في المدار الأخير أو الإلكترونات التكافؤ هي التي تحدد الدورة التي ينتمي إليها العناصر.
- تتشابه عناصر المجموعة الواحدة داخل الجدول الدوري في خصائصها والتركيب الإلكتروني الذي يتواجد في المدار الأخير.
أهمية الجدول الدوري
يلعب الكيمياء دورًا كبيرًا ومهمًا، خاصةً للطلاب والعلماء والباحثين المهتمين بعلم الكيمياء، ولذلك نجد أهميتها تتمثل في عدة نقاط، منها
- يمكن تحديد موقع العنصر في المجموعة أو الدورة بكل سهولة.
- التعرف على سلوكيات العنصر الكيميائي.
- التعرف على البنية الإلكترونية لذرة العنصر
- يتضمن دراسة العنصر التنبؤ بالتفاعلات الكيميائية المختلفة التي يمكن أن يشارك فيها.
المراجع :