التوزيع الإلكتروني هو موضوع يحتوي على عدة أجزاء في تكوين الذرة، ولكلٍّ من تلك الأجزاء أهميتها الخاصة التي تجعلها تحافظ على ترابط بعضها البعض، وتحقق التوازن للذرة ككل، وذلك عن طريق ترتيب مكوناتها. وهذا ما يشكل الأساس للتوزيع الإلكتروني. وفيما يلي مقال يتضمن المزيد من التفاصيل .
التوزيع الالكتروني موضوع
- يتمثل توزيع الإلكترونات في أي نظام توزيع إلكتروني ثابت في الحالة الأرضية، وإلا سيتعرض أحد الإلكترونات إلى التفريغ الكهربائي أو التسخين، وبالتالي يتم تغيير توزيع الإلكترونات إلى توزيع مؤقت آخر.
- وتم استنتاج وجود التوزيع الإلكتروني من خلال هذا الفراغ الضَّيَّق للجزيء والمحدد بالكم، أَو أَنَّهُ يكون مقيّد لحالة كمية محددة، وهذه الحالات هي المدارات الإلكترونيَّة، والحالات المُقصودة دائمًا مختلِفَة.
- يوضح المبدأ الذي ينص على استحالة وجود اثنين من الفرميونات أو الإلكترونات في نفس الحالة الكمية، وهو مبدأ استبعاد باولي، ويؤكد وجود التوزيع الإلكتروني وعدم تشابه الإلكترونات في النفقات الكمية إذا تم تملؤها بالكامل.
- نظرًا لعدم استقرار الحالة الكمومية للإلكترون عند تشغيل مستوى طاقة ليس في مستواه الأصلي، فإن هذا الإلكترون ينتقل إلى جزء من الثانية للعودة إلى مستواه الأصلي، وتنبعث منه الطاقة الزائدة في شكل شعاع ذو تردد محدد.
- ومن أجل تحديد توزيع الإلكترونات في أي نظام، يجب معرفة عددها في النظام، ومن ثم تحديد مستويات الطاقة الرئيسية والفرعية والأوربيتالات، ويتعين التعرف على المدارات لتحديد هذا التوزيع، وهو ما يقوم به علماء ميكانيكا الكم.
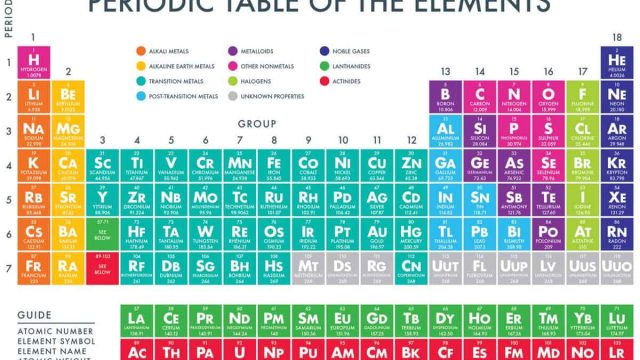
التوزيع الالكتروني للعناصر
- يعني التوزيع الإلكتروني للعنصر كيفية توزع الإلكترونات في مدارات ذرته.
- تتوزع الإلكترونات في مدارات 2 ن 2، حيث يمثل ن مستوى الطاقة.
- تتمثل الحد الأقصى لمستوى الطاقة الأول في توفير 2 إلكترون، والثاني يتكون من 8 إلكترونات، والثالث يحتوي على 18 إلكترونًا.
- يتم حساب العدد الذري للعنصر من خلال ضرب عدد البروتونات في النواة، أو ضرب عدد الإلكترونات في النواة مع حالة الذرة المتعادلة.
- يمكن التعرف على المزيد من الخصائص الكيميائية للعنصر ونشاطه الكيميائي من خلال توزيع الإلكترونات للعنصر.
- أما بالنسبة لقواعد التوزيع الإلكتروني للعنصر، فهي تظهر في :
- قاعدة أوف باو، أو مبدأ البناء التصاعدي، ينص على أن الإلكترونات تدخل المستويات الفرعية ذات الطاقة المنخفضة أولاً، ثم تمتلئ المستويات العليا بعد ذلك.
- يفسر مبدأ باولي للاستبعاد أنه من غير الممكن أن تكون أعداد الكم الأربعة لأي إلكترونات في ذرة واحدة متساوية.
- تقوم قاعدة هوند على افتراض أن الإلكترونات تميل للبقاء وحيدة في المدار الذري، ما لم يكن عددها أكبر من عدد المدارات.
- وللوصول إلى التركيب الإلكتروني الصحيح للذرة، يجب مراعاة ما يلي:
- عدد الإلكترونات التي توزع على المدارات الذرية يساوي العدد الذري للعنصر.
- يجب ألا يحتوي المدار الواحد على أكثر من إلكترون.
- يجب اتباع قاعدة هوند عند توزيع الإلكترونات في المدارات بالمستويات الفرعية.
- يتعين توزيع الإلكترونات بدءًا من المدار ذو الطاقة الأقل، حيث يكون المدار ذو الطاقة الأعلى هو الذي يتم توزيع الإلكترونات عليه في المرحلة الأخيرة.
التوزيع الإلكتروني في الجزيئات
- نظرًا لاختلاف التركيب المداري لكل جزيء، فإن عملية حساب التوزيع الإلكتروني تصبح أكثر تعقيدًا، ويمكن الاعتماد هنا على `طريقة الاندماج الخطي للمدارات الجزيئية`، التي تحسب المدارات الجزيئية في الكيمياء الكمية.
التوزيع الإلكتروني في المواد الصلبة
- يختلطُ التوزيعُ الإلكترونيُّ مع النطاقاتِ المستمرةِ للحالات، ويكونُ تصورُ التوزيعِ الإلكتروني الثابتِ قد توقفَ وتم استخدامُ `نظريةِ النطاقِ`
وبصورة عامة، فإن التركيز على دراسة توزيع الإلكترونات بين العناصر الكيميائية المختلفة، وكذلك بين الحسابات الكيميائية والفيزيائية، قد أدى إلى إنشاء مجال فهم محتوى الذرة المميز، الذي يمكن الاعتماد عليه بشكل علمي دقيق ومبسط في تحديد كافة العناصر والجزيئات.