نقدم لك، عزيزي القارئ، بحثا حول توزيع الإلكترونات في الذرات، وهو ترتيب الإلكترونات في المدارات الذرية. يحمل كل مدار عددا محددا من الإلكترونات. يعمل هذا الترتيب الإلكتروني على تنظيم الإلكترونات داخل الذرات ويسبب استقرار الجزيئات من خلال الأغلفة الخارجية. نشرح طريقة هذا التوزيع الإلكتروني في مقالنا. تابعنا لمعرفة المزيد.
بحث عن التوزيع الالكتروني
يستند توزيع الإلكترونات إلى توزيع الشحنات السالبة في المدارات المقبولة لعدد معين من الإلكترونات، وتعتبر الإلكترونات هي الجزء الحامل للشحنة السالبة بينما تحمل البروتونات الشحنة الإيجابية داخل النواة.
عندما تدور الإلكترونات السالبة حول النواة، يتم جذبها إلى البروتونات، وعلى العكس من ذلك، فإن التنافر بين الشحنات السالبة للإلكترونات هو ما يؤدي إلى إعادة تشكيل مواقع الإلكترونات في مدارات الطاقة حول النواة.
شرح التوزيع الإلكتروني
يطرح العديد من دارسي العلوم، وخاصةً في مجال الكيمياء، السؤال عن السبب وراء استقرار الإلكترونات في مداراتها المخصصة والحفاظ على مواقعها، فما هو التوزيع الإلكتروني وكيف يتم شرحه بالتفصيل؟:
- يعتمد بقاء الإلكترونات في المدارات التي تطوف حول النواة على مبدأ استبعاد بولي، الذي يشير إلى أن الإلكترونات لا يمكن أن تكون متساوية في الأرقام الكمية الأربعة في ذرة واحدة.
- ونجد أيضًا أن هذا المبدأ ينص على أن الحد الأقصى لعدد الإلكترونات في المدارات الذرية هو اثنان.
- في حال وجود إلكترونين في نفس المدار، فإنهما يتحركان باتجاه متعاكس ومتضاد لبعضهما البعض.
- فيما يتعلق بحركة دوران الإلكترونات، يجب أن تكون حركتها متعاكسة لبعضها البعض، بالإضافة إلى عدم تساوي الأعداد الأربعة بين الإلكترونات، ويجب أن يظهر اختلاف في العدد الرابع إذا كانت الأعداد الأولى الثلاثة متشابهة.
- توزع الإلكترونات في سبع مدارات مختلفة، ويتم ذلك بناءً على العدد الذري للإلكترونات.
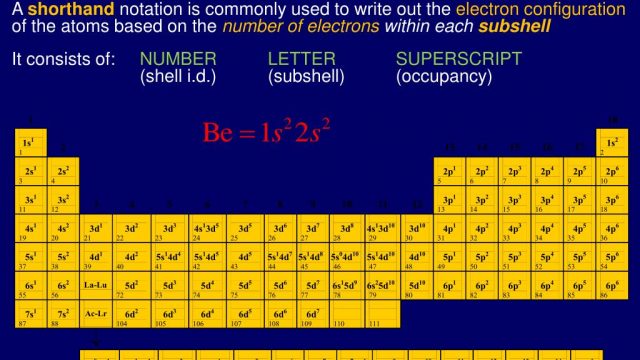
- تعتمد طريقة توزيع الإلكترونات على توزيعها في المدارات الرئيسية والثانوية، وترمز لهذه المدارات بالأحرف S، P، d، f، حيث تمثل المدارات الثانوية الموجودة في المدارات الرئيسية.
طريقة التوزيع الإلكتروني
تستند طريقة التوزيع الإلكتروني على فهم الأعداد الذرية لكل من المدارات الرئيسية والفرعية التي تتسع للتوزيع الإلكتروني في المدارات الفرعية، لذا دعونا نتعرف على أساليب التوزيع الإلكتروني من خلال السطور التالية:
- تعتمد التوزيع الإلكتروني على قاعدة مهمة وهي أن المدارات الفرعية تحتوي على عدد محدد من الإلكترونات، ويتم تمييز هذه المدارات بالحروف s و p و d و f، وعلى سبيل المثال، يتم توزيع عنصر النيون في المدارات الثانوية كالتالي: 3s² 3p³.
- الأرقام العلوية التي توضع فوق الحروف في المدارات الفرعية تمثل عدد الإلكترونات، وعدد قبل الحروف يمثل المستويات الطاقية الموجودة في كل مدار.
- بالنسبة لمستويات الطاقة في كل مدار فرعي، فإن المدار الفرعي S يحتوي على مدار واحد، والمدار الفرعي P يحتوي على 3 مدارات فرعية، والمدار D يتكون من 5 مدارات، وأخيرًا المدار F يتكون من 7 مدارات.
- تتم توزيع الإلكترونات وفقًا للمدارات التي يجب تشبعها تدريجيًا، فإذا كان الهدف هو توزيع خمس إلكترونات، يجب وضع إلكترون واحد في المدار S أولاً، ثم توزيع ثلاث إلكترونات في المدار P الذي يمكن أن يتسع لهذا العدد فقط، ويتبقى إلكترون واحد ليتم توزيعه في المدار D .
التوزيع الإلكتروني للكربون
يمكن للطالب العزيز فهم طريقة توزيع الكربون الإلكتروني عن طريق اتباع الخطوات العلمية التالية:
- يُرمز كيميائيًا إلى الكربون بالرمز 6C.
- يحمل الكربون 6 أعداد ذرية.
- يتم توزيع الإلكترونات في الذرات وفقًا لقاعدة التوزيع الإلكتروني، 2n2، حيث يمثل n مستوى الطاقة.
- توزيع الكترونات عنصر الكربون هو 1s2 2s2 2p2 .
التوزيع الإلكتروني للكلور
يسأل العديد عن التوزيع الإلكتروني للكلور الذي يحمل الرمز الكيميائي CL، وسوف نوضح هذا فيما يلي:
- يحمل الكربون 17 أعداد ذرية.
- يتم توزيع الإلكترونات في الذرات وفقًا لقاعدة التوزيع الإلكتروني، 2n2، حيث يمثل n مستوى الطاقة.
- ليأتي التوزيع الإلكتروني للكلور 3s2 3p5 .
التوزيع الإلكتروني المختصر
- يتم توزيع الإلكترونات على المستويات الطاقوية المختلفة، ولكل مستوى طاقة استيعابية محددة، ففي المستوى الأول يوجد إلكترونان، وفي المستوى الثاني يوزع 8 إلكترونات، وأخيراً يحمل المستوى الثالث 18 إلكترونًا.
- يحتوي الذرة المتعادلة على عدد من الإلكترونات يساوي عدد البروتونات.
- ويتم التحكم في توزيع الإلكترونات وفقًا لقاعدة استبعاد بولي وأوف باو وهوند.
قاعدة أوف باو aufbau principle
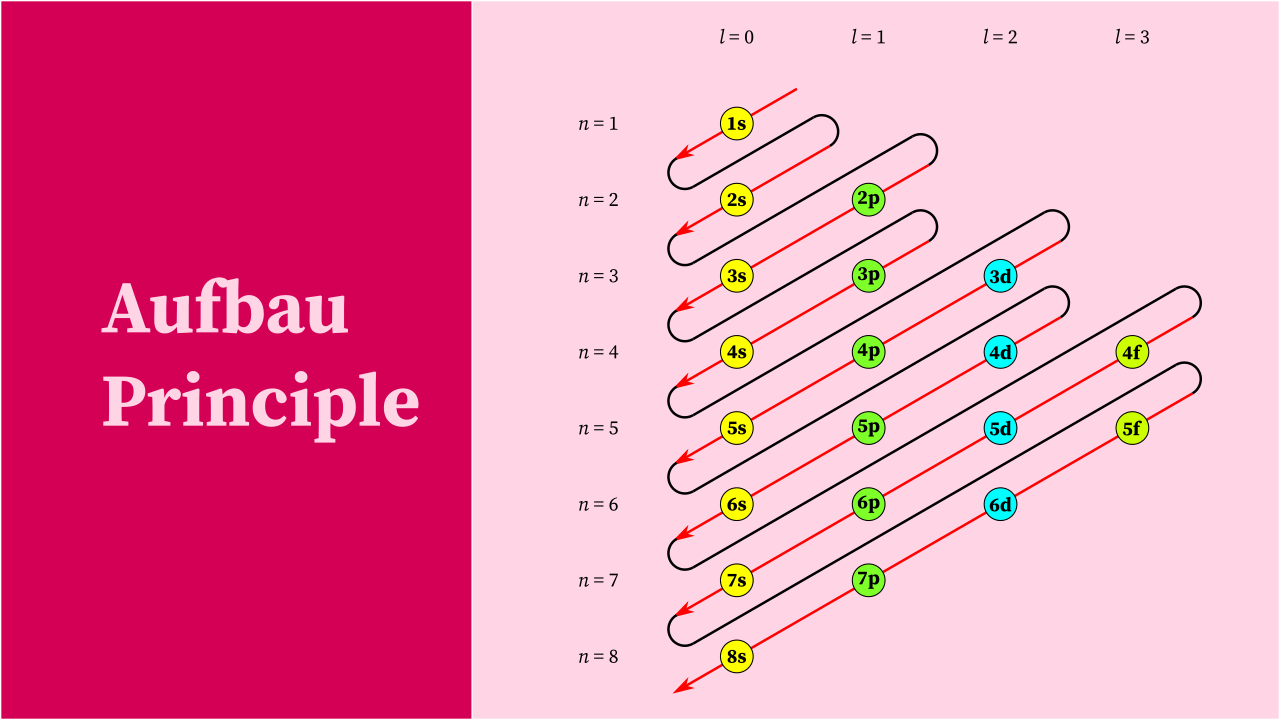
- تعبر هذه القاعدة عن توزيع الإلكترونات في المستويات الفرعية للطاقة، ومن ثم تتدرج باتجاه المستويات الأعلى.
- تشغل المدارات S أولًا، ولكن طاقة المدارات تختلف وفقًا لعدد الكم الذي يُرمز له بحرف N.
- يتم تعبئة المدار الأول S بعدد 2 إلكترون، ثم المدار P بعدد 6 إلكترونات، بينما يتسع المدار D لـ 10 إلكترونات، ويتسع المدار f لـ 14 إلكترونًا.
قاعدة هوند Hund’s Rule
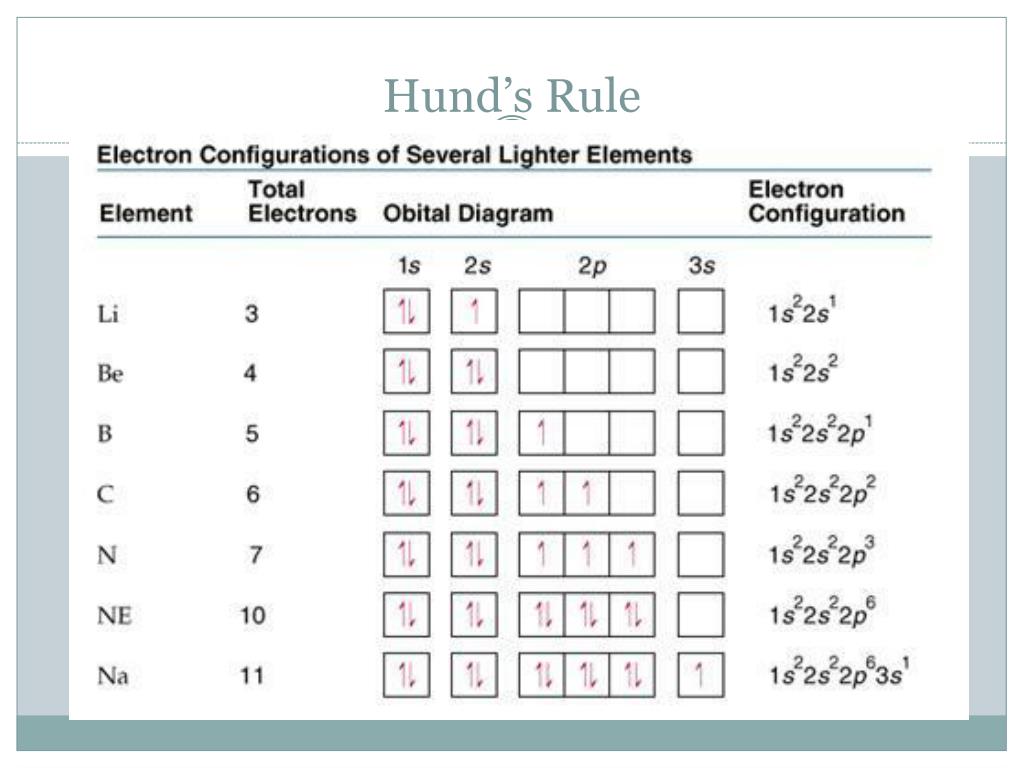
- تشير هذه القاعدة إلى قاعدة هوند لتوزيع الإلكترونات، حيث يتم ملء المدارات الفرعية في كل مدار بالإلكترونات، وعلى سبيل المثال، إذا كان لدينا P ولديها ثلاث مدارات فإنها لا تحتوي على أكثر من إلكترون واحد في كل مدار.
- في حالة وجود عدد لا يتجاوز ثلاثة إلكترونات، يتم توزيعها على الثلاثة مدارات الداخلية في p، وعندما يكون هناك عدد أكبر من الإلكترونات، يتم دمجها حتى يحصل كل مدار على عدد الإلكترونات الكافي.
تناول مقالنا شرحًا للتوزيع الإلكتروني والقواعد الأساسية التي يتم الاعتماد عليها في هذا التوزيع والذي يحدث في كل مدار، بالإضافة إلى تقديم شرحٍ مُختصر لطريقة هذا التوزيع وتوضيح أمثلة عليه.
يُمكنك عزيزي القارئ متابعة المزيد عبر الموسوعة العربية الشاملة بقراءة موضوع عن التوزيع الالكتروني .
المراجع